前回の第1回記事では、半導体結晶成長技術の重要性と半導体材料の歴史的変遷について触れた後、結晶の対称性の破れが半導体結晶に結晶欠陥をもたらして半導体結晶の特性を損ない、ひいては半導体デバイスチップの性能に悪影響をもたらすのではないかという問題意識を一般的な立場から紹介した。今回以降は、その実情を具体的に紹介しながら半導体結晶の材料による違いと共通点を結晶対称性の観点から改めて考えてみたい。まず最初に、数ある物質の中での半導体結晶の特徴をあらためて振り返ってみることにする。その後、半導体結晶の代表格であるSiとGaAsを取り上げ、その違いを対称性の観点から見直してみたい。
3.半導体の結晶構造の特徴
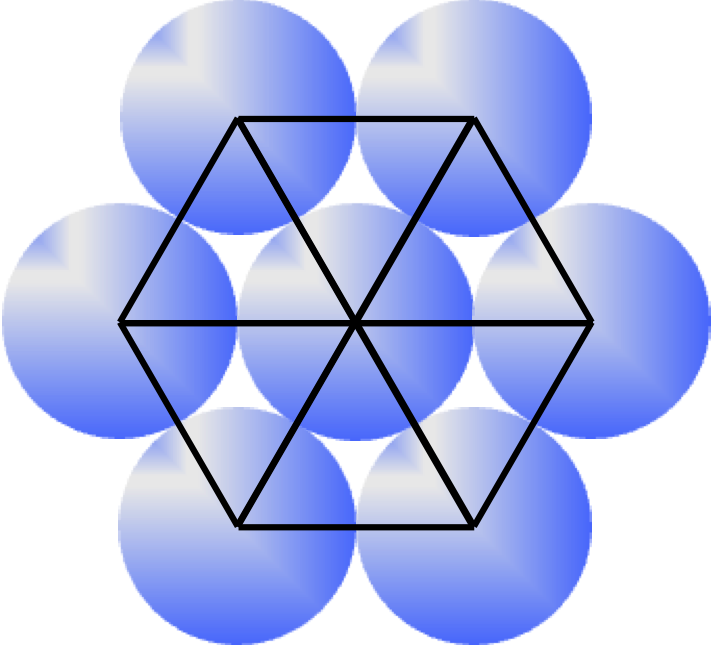
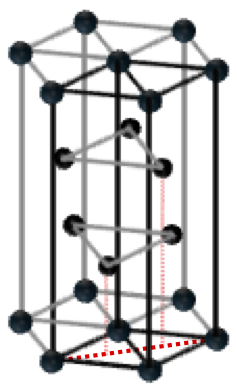
物質を大きく分類すると、絶縁体、半導体、金属に分かれることはよく知られている。一方、固体である結晶の結合様式としては、イオン結合、共有結合、金属結合、ファンデアワールス結合等があるが、半導体結晶は多くの場合、共有結合を主体としてそこにイオン結合の性格が加わる。金属やNaCl等のイオン結晶は結合に方向性はないが、共有結合では結合に方向性が存在し、結晶の中では結合の間に特定の方位関係がなり立つ。俗な言い方をすれば、構成原子の特定の方位に”結合手”が出ている状況であり、その結果原子層が積層する場合には上の層は下の層に対して特定の位置に配置されることになる。固体としての結晶では化学結合によってできるだけ原子は凝集しようとする。その性質から半導体結晶のもとになる構造として、最密充填構造である面心立方構造(FCC)と六方最密構造(HCP)が重要である。この両構造について少し眺め直してみよう。
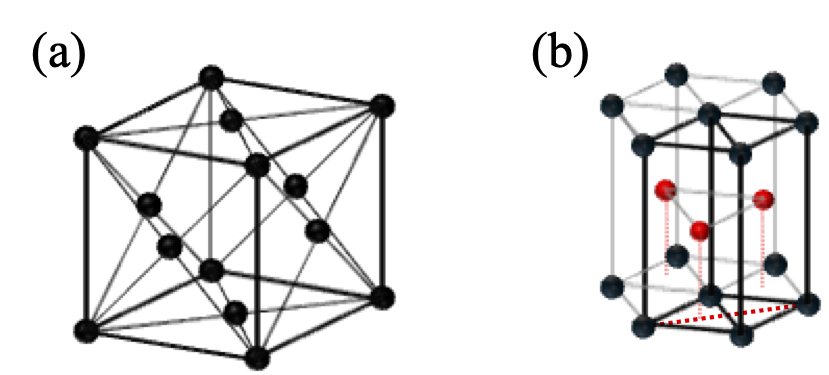
位置する原子を表す。(a)では太実線でBravais格子としての面心立方格子のユニットセルを示す。一方、(b)では太実線がBravais格子としての単純六方格子のユニットセルを示しており、赤丸で表される原子の位置は格子点にはならない。
まず、この両構造を結晶格子として図2-1に示すが、FCCでは<111>方向、HCPでは<0001>方向に垂直な面内で構成原子が2次元の最密充填構造(図2-2参照)を取り、その最密充填層が<111>方向、<0001>方向にそれぞれ積み重なった構造になっている。比較のために、FCC構造の<111>方向を垂直に描いたものも図2-3に示す。ここで図中の六角柱は、構造が理解しやすいように描いたもので、いずれの構造でもユニットセルではなく、その整数倍の体積をもっていることにご留意いただきたい。図2-1中の黒丸及び赤丸の位置を以後最密充填サイトと定義するが、最密充填サイトに原子をおいたうえで、ある1つの原子から見ると、両者とも層内で6配位、上下の層で各々3配位、合計12配位している。即ち、12個の原子に等しく囲まれている。一方、これらの原子の間には、ある種の”空孔”が存在している。これらの空孔には別途原子を配置することが可能である。このうち、4個の原子に囲まれた空孔に原子を配置したケースは、正4面体構造として半導体の教科書によくでてくるものである。また、正四面体ほど知られていないがそれとは別に、6個の原子に囲まれた空孔も存在しており、囲んでいる原子は正8面体の構造を取る。FCCのユニットセルは、正4面体構造を8個、正8面体構造を2個含んでいる。一方、HCPのユニットセル(六角柱ではない)では、正4面体構造を4個、正8面体構造を2個含んでいる。この個数を数える際、当該サイトがユニットセルの頂点や辺上に存在する場合は、適宜隣接するユニットセルと共有するとしてそれぞれの個数を計算する必要がある。FCC及びHCPユニットセル中の正4面体構造、正8面体構造を見やすくしたものを図2-4に示す。両構造でFCC及びHCPユニットセル内の空間は隙間なく埋め尽くされる。ここまでこれらの正多面体構造は最密充填サイトから構成されるとし、その中心位置(重心)に空孔があるとした。一方、正4面体構造、正8面体構造とも1つの最密充填サイトから見ると、それを取り囲んでいる空孔もそれぞれ正4面体、正8面体を形作っており、最密充填サイトがその重心位置にある。まさに相補的になっており、最密充填サイト及び空孔サイトに実際に原子を配置すれば、両サイトの区別も必要なくなってしまう。
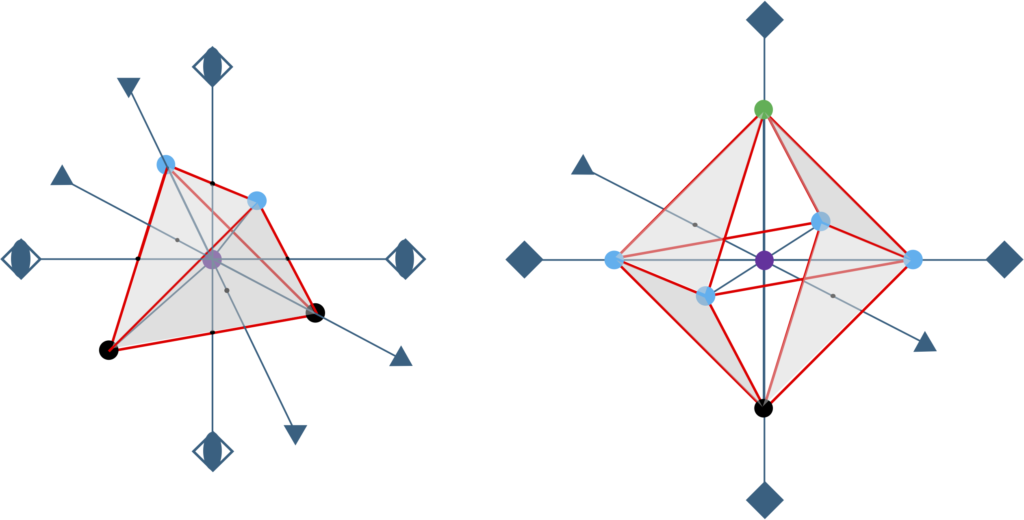
さて、図2-4に示す正4面体構造であるが、メタン(CH4)など共有結合によって形成される分子においてもよく現れる構造である。メタンでは、その”結合手”はsp3混成軌道として知られる原子軌道であり、隣接する原子間でこの”結合手”が重なり合って共有結合が形成される。半導体結晶においても同様に、構成原子のsp3混成軌道が次々と重なり合って共有結合が繋がり、固体として連続的な結晶となる。この時、構成原子の4つのsp3混成軌道がどのような方位を向いているかというと、正に正4面体の重心から各頂点に伸びる4本のベクトルに一致する状況にある。幾何学的に最密充填構造から導かれた4配位正四面体構造が、共有結合のもととなるsp3混成軌道と形状が一致している点は極めて興味深い。言い換えれば、sp3混成軌道を形成できる半導体材料の構成原子を結晶内に配置するのに、FCCやHCPの最密充填サイトと空孔サイトは極めて都合が良いのである。
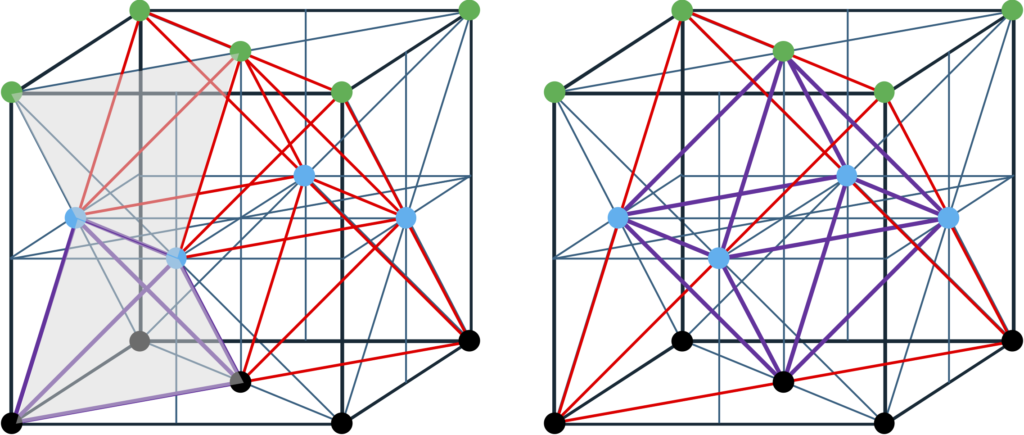
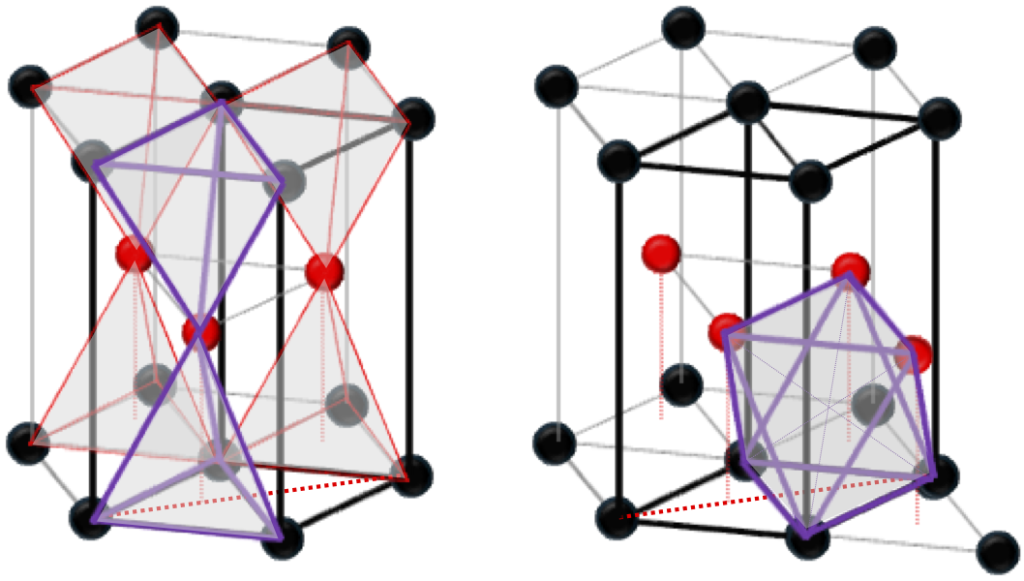
図2-5に今まで述べた正4面体構造と正8面体構造の対称要素の一部を示すが、これらの構造を格子点に配置した場合には出来上がる結晶構造の対称性(空間群)にこれら構造の対称性(結晶点群)が反映される。自然界に存在する結晶構造を、これらの正4面体構造と正8面体構造の観点から分類することもよく行われる。以下に頻繁に見られる結晶構造のいくつかを俗称的な名称として紹介するが、両正多面体構造を意識するとそれぞれの相互関係がある程度見えてくる。
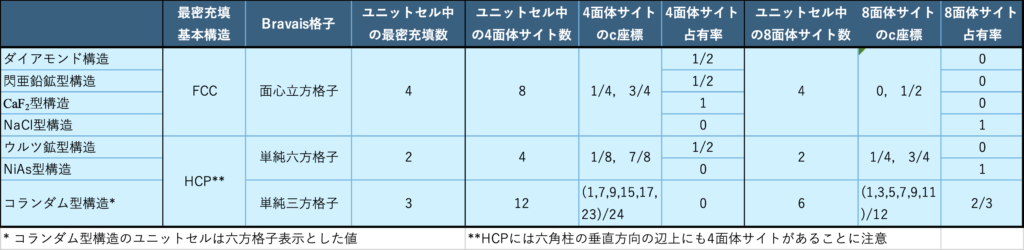
FCCユニットセルの4面体サイトの1/2に格子点と同じ原子を規則正しく配置したものが”ダイヤモンド構造”(Si, Ge等が属する)、異なる原子を配置したものが”閃亜鉛鉱型構造” (GaAs, 3C-SiC等が属する)である。因みに、4面体サイト全てに異なる原子を配置すると”CaF2(ホタル石)型構造”、 8面体サイト全てに異なる原子を配置すると”NaCl型構造”となる。またHCPユニットセルでは、4面体サイトの内1/2に異なる原子を規則正しく配置すると、”ウルツ鉱型構造”(GaN等が属する)となる。更に、四面体サイトではなく8面体サイト全てに異なる原子を配置したものが”NiAs型構造”として知られているものであり、興味深いことにその2/3だけに異原子があるものが”コランダム型構造”(α-Ga2O3等が属する)である。これらの構造の違いを表2-1にまとめる。